利用激光共聚焦显微镜对荧光标记的组织样品进行观察已经是一种常用的生物学研究手段,而一个好的样本切片同样是共聚焦成像质量的关键。那么做科研的小伙伴是不是还在为了自己的样本制备而烦恼呢?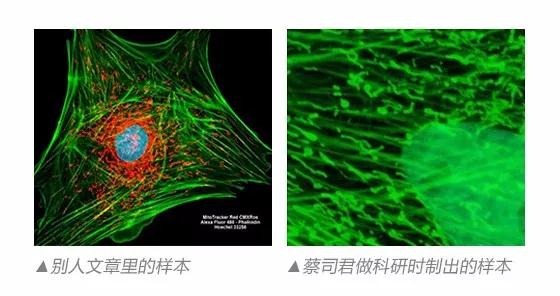
经过高人指点和多次的摸索,蔡司君终于也可以制出高质量的样品啦,今天就给大家发福利。
敲黑板!
共聚焦显微成像中常用的切片有两种:
生物标本的制作步骤:
固定→脱水→包埋→切片→抗原修复→封闭→染色→封片→观察
(如果是细胞样品,其中脱水、包埋和切片是不需要的)
划重点:
1.固定
保持细胞和组织的形态结构以及抗原的免疫活性
固定液 | 固定部位 |
甲醇(分析纯or HPLC) + -20℃ 10min | 细胞膜 |
丙酮(HPLC)+ -20℃ 10min | 细胞骨架/微管蛋白 |
4%多聚甲醛+0.2%Saponins10min | 细胞核核膜 |
4%多聚甲醛15min + -20℃ 甲醇5min | 胞浆蛋白+细胞膜 |
4%多聚甲醛15min + -20℃ 丙酮5min | 胞浆蛋白+细胞骨架/微管蛋白 |
4%多聚甲醛10min @RT+4 ℃10min+ -20℃ 甲醇1min | 细胞膜+胞浆蛋白+细胞核 |
 注意:
注意:
2.脱水、包埋
 注意:
注意:
3.切片
使用锋利无缺口的刀片,刀片与样品的角度通常成30~45°角,切片后可在65℃下加热脱蜡或者用水洗去OCT
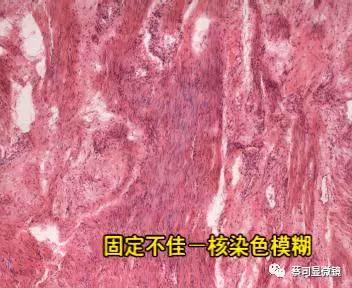
不要小看这几步哦,因为一不小心片子就成了这样:
4.抗原修复
由于样品在制作过程中,部分抗原的肽链在一些试剂的作用下会发生扭曲,在免疫组化的染色过程中不能将其暴露出来。为了解决此问题,利用化学试剂和热的作用将这些抗原重新显示出来的过程。
步骤:
根据实验来选择不同pH的修复液
温度:92-98℃(95℃比较理想)
时间:3小时左右
冷却:自然降温,不可放在冰箱里降温
 注意:
注意:
5.封闭
对非特异性蛋白位点进行封闭,可以有效降低样品的背景信号
配方:1×PBS中加入5% BSA+10% 二抗种属来源的正常血清
6.抗体(一抗、二抗)
方法:
 注意:
注意:
选择一抗时应先做梯度稀释的预实验,便于摸索出合适浓度的抗体
多重荧光标记时:
不同种属来源的荧光抗体可一起标记
同一种属来源的抗体,可先标记效价低的抗体
并且,在同一种属来源的第一个一抗、二抗标记后可用5% BSA短暂封闭5分钟,再标记第二个一抗、二抗
由于二抗通常带有荧光素标记,选择时要尽量避免荧光串色
7.染色
 注意:
注意:
同时,在这里给大家推荐蔡司的APP(Light Lab,可在Apple Store中下载)可供大家查阅探针、染料或者荧光蛋白的相关光谱信息。
8.封片
选择商品化的带有抗荧光淬灭剂的封片剂,而不要选择指甲油(封片效果不好且有害健康)
方法:封片时用镊子夹住盖玻片的一端,沿着一个方向盖好,避免产生气泡
如此,一张好看的玻片就制好了。在共聚焦显微镜下观察,是不是效果杠杠滴~

满满的干货技能,希望小伙伴可以从中get到关键的细节,往往可以事半功倍哦!